Azenta安升达
入驻年限:6 年
- 联系人:
安升达
- 所在地区:
江苏
- 业务范围:
技术服务、细胞库 / 细胞培养、论文服务、试剂、原辅料包材、实验室仪器 / 设备、书籍 / 软件、耗材、医疗器械
- 经营模式:
生产厂商
公司新闻/正文
一文了解环状 RNA 合成服务,助力开启 mRNA2.0 时代!
人阅读 发布时间:2023-04-25 15:18
背景
环状 RNA (circRNA)是一类具有特殊结构的单链 RNA 分子,没有 5' 端帽子结构,也没有 3' 端 ployA 尾巴,以共价键形成环状结构,缺乏游离末端,因此不易被核酸外切酶降解。
circRNA 可分为两种:内源性 circRNA 和外源性 circRNA。内源性 circRNA:具有在真核生物中丰富、进化上保守、组织特异性表达、高度稳定,可在神经组织中随衰老而积累等特点。外源性 circRNA:是先在体外转录出线性 mRNA,随后采用不同的环化策略将线性 mRNA 进行环化。体外合成的 circRNA 和与线性 mRNA 相比具有更长的半衰期,更高的蛋白表达效率等优点。
应用方向
疾病机制:早在 1976 年发现 circRNA,但直到 2012 年以后,得益于高通量测序技术的发明、富集 circRNA 方法的出现以及计算方法的改进,研究人员才发现 circRNA 大量存在于真核生物体内并发挥着重要作用。包括参与多种疾病的发生和进展过程,如癌症、心血管疾病、代谢性疾病、炎症和神经退行性疾病等。
药物研发:在生物学中心法则中,RNA 位于承上启下的特殊位置,成为治疗疾病的重要突破口,也展现了开发治疗各类疾病药物的巨大潜力。2022 年 6 月 27 日,汉诺威医学院 Thomas Thum 和 Christian Bär 团队在 European Heart Journal(IF 35.855) 发表文章人工制备的 Circ-INSR 模拟物在体外转录后,对阿霉素诱导的心肌细胞 DNA 损伤显示出强烈的心脏保护作用。
细胞治疗:Orna Therapeutics 公司在 2022 年美国细胞基因治疗行业会议上公布了一项研究结果:不需要从患者体内分离 T 细胞,利用 LNP 向 T 细胞中递送编码抗原嵌合受体(CAR)的 circRNA,可以成功清除小鼠体内的癌细胞。这是 circRNA 首次在体内研究中展现疾病治疗潜力。
疫苗研发:2022 年 3 月 31 日,北京大学魏文胜团队在 Cell 在线发表论文,该研究报告了一种 circRNA 疫苗,通过表达 S 蛋白的三聚体 RBD,诱导有效的中和抗体和 T 细胞免疫反应,在小鼠和恒河猴中提供针对变种 SARS-CoV-2 的强大保护。
circRNA 体外环化策略
mRNA 在 RNA 疫苗、基因编辑、多能干细胞的生成以及基于 RNA 扩增的诊断技术的开发等领域具有较大的应用潜力。但因其化学结构不稳定,易被 RNase 降解,导致药效时间较短,无法完全发挥出 mRNA 药物的作用。而体外合成的 circRNA 是封闭的环状结构,有更高的稳定性,不易降解,不需要加帽加尾,生产成本更低廉,有望解决线性 mRNA 面临的诸多挑战。
体外合成 circRNA 的环化策略主要有 3 种:化学方法、连接酶方法(T4 RNA ligases)和核酶方法(group Ⅰ、group Ⅱ self-splicing introns)。
1. 化学合成法
线性 RNA 可通过 BrCN 或 1-乙基-3-(3-二甲氨基丙基) 碳二亚胺 (EDC) 进行首尾连接成环。化学连接法由于磷酸迁移形成的是 2’-5’-磷酸键,而非天然的 3'-5' 磷酸二酯键。

化学合成法实现 RNA 的环化
2. 连接酶方法
连接酶法又分为两种:一种是传统方法,需要借助夹板链或辅助链,拉近 5’ 和 3’ 端的距离,通过 T4 连接酶连接成环。由于 T4 连接酶连接效率较低,并需要借助夹板链或者辅助链,不利于后续的纯化,也不利于工业化生产。因此衍生了一种借助内源性的夹板链制备 circRNA 的方法,该方法采用末端互补配对形成二级结构的方法再通过 T4 RNA ligase2 连接分子内成环。

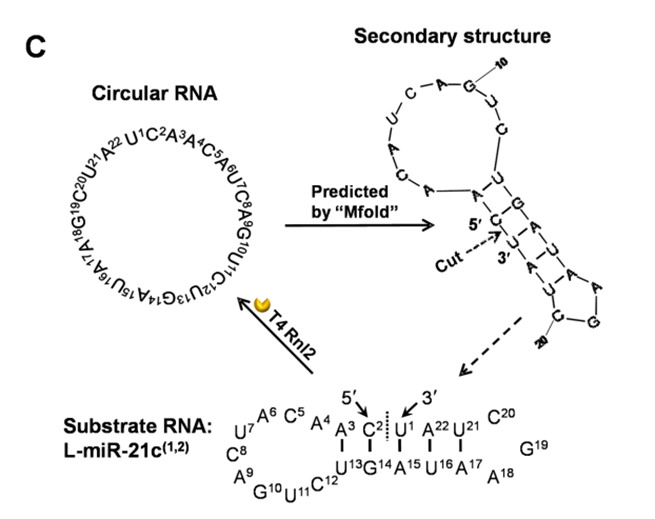
基于连接酶法,借助夹板链或者二级结构成环
3. 核酶方法
核酶是具有酶催化作用的一类 RNA,主要包括Ⅰ型自剪接内含子(groupⅠ self-splicing introns)和Ⅱ型自剪接内含子(groupⅡ self-splicing introns)。通过内含子和外显子序列重新排列(Permuted Intron Exon, PIE),基于 I 型或 II 型内含子的自剪接功能剪接成环。
I 型内含子自剪接:
通过改造鱼腥藻(Anabaena)或 T4 噬菌体 I 型内含子提高了体外编码 RNA 的环化效率,在 Mg2+ 和 GTP 存在下,发生两次酯交换反应,形成 circRNA。为了进一步提高自剪接前体 RNA 成环效率,通过增加同源臂 (homology arm)、间隔序列 (spacer),解决长编码 RNA 序列成环的难题,并且能够得到较好的成环效率。并且筛选出的 IRES 增强了 circRNA 在细胞内蛋白表达的稳定性和效率。这种成环策略由于增加了间隔序列且外显子序列较长,所以需要在最终的 circRNA 产物中分别额外引入 176nt(Anabaena)和 74nt(T4 bacteriophage)碱基序列。
II 型内含子自剪接:
II 型内含子来源于原生生物、真菌以及细菌基因组中。与 I 型内含子 PIE 系统相比,使用 II 型内含子不需辅助外显子序列,即可产生预期的 circRNA 序列,但是该方法剪接效率低,成环条带中含有的 nicked RNA 需要进一步鉴定,广泛适用性仍需更多研究验证。

基于 PIE 系统自剪接机制
不同环化方法的比较

安升达 circRNA 合成服务
制备流程

服务优势
环状 RNA (circRNA)是一类具有特殊结构的单链 RNA 分子,没有 5' 端帽子结构,也没有 3' 端 ployA 尾巴,以共价键形成环状结构,缺乏游离末端,因此不易被核酸外切酶降解。
circRNA 可分为两种:内源性 circRNA 和外源性 circRNA。内源性 circRNA:具有在真核生物中丰富、进化上保守、组织特异性表达、高度稳定,可在神经组织中随衰老而积累等特点。外源性 circRNA:是先在体外转录出线性 mRNA,随后采用不同的环化策略将线性 mRNA 进行环化。体外合成的 circRNA 和与线性 mRNA 相比具有更长的半衰期,更高的蛋白表达效率等优点。
应用方向
疾病机制:早在 1976 年发现 circRNA,但直到 2012 年以后,得益于高通量测序技术的发明、富集 circRNA 方法的出现以及计算方法的改进,研究人员才发现 circRNA 大量存在于真核生物体内并发挥着重要作用。包括参与多种疾病的发生和进展过程,如癌症、心血管疾病、代谢性疾病、炎症和神经退行性疾病等。
药物研发:在生物学中心法则中,RNA 位于承上启下的特殊位置,成为治疗疾病的重要突破口,也展现了开发治疗各类疾病药物的巨大潜力。2022 年 6 月 27 日,汉诺威医学院 Thomas Thum 和 Christian Bär 团队在 European Heart Journal(IF 35.855) 发表文章人工制备的 Circ-INSR 模拟物在体外转录后,对阿霉素诱导的心肌细胞 DNA 损伤显示出强烈的心脏保护作用。
细胞治疗:Orna Therapeutics 公司在 2022 年美国细胞基因治疗行业会议上公布了一项研究结果:不需要从患者体内分离 T 细胞,利用 LNP 向 T 细胞中递送编码抗原嵌合受体(CAR)的 circRNA,可以成功清除小鼠体内的癌细胞。这是 circRNA 首次在体内研究中展现疾病治疗潜力。
疫苗研发:2022 年 3 月 31 日,北京大学魏文胜团队在 Cell 在线发表论文,该研究报告了一种 circRNA 疫苗,通过表达 S 蛋白的三聚体 RBD,诱导有效的中和抗体和 T 细胞免疫反应,在小鼠和恒河猴中提供针对变种 SARS-CoV-2 的强大保护。
circRNA 体外环化策略
mRNA 在 RNA 疫苗、基因编辑、多能干细胞的生成以及基于 RNA 扩增的诊断技术的开发等领域具有较大的应用潜力。但因其化学结构不稳定,易被 RNase 降解,导致药效时间较短,无法完全发挥出 mRNA 药物的作用。而体外合成的 circRNA 是封闭的环状结构,有更高的稳定性,不易降解,不需要加帽加尾,生产成本更低廉,有望解决线性 mRNA 面临的诸多挑战。
体外合成 circRNA 的环化策略主要有 3 种:化学方法、连接酶方法(T4 RNA ligases)和核酶方法(group Ⅰ、group Ⅱ self-splicing introns)。
1. 化学合成法
线性 RNA 可通过 BrCN 或 1-乙基-3-(3-二甲氨基丙基) 碳二亚胺 (EDC) 进行首尾连接成环。化学连接法由于磷酸迁移形成的是 2’-5’-磷酸键,而非天然的 3'-5' 磷酸二酯键。

化学合成法实现 RNA 的环化
2. 连接酶方法
连接酶法又分为两种:一种是传统方法,需要借助夹板链或辅助链,拉近 5’ 和 3’ 端的距离,通过 T4 连接酶连接成环。由于 T4 连接酶连接效率较低,并需要借助夹板链或者辅助链,不利于后续的纯化,也不利于工业化生产。因此衍生了一种借助内源性的夹板链制备 circRNA 的方法,该方法采用末端互补配对形成二级结构的方法再通过 T4 RNA ligase2 连接分子内成环。


基于连接酶法,借助夹板链或者二级结构成环
3. 核酶方法
核酶是具有酶催化作用的一类 RNA,主要包括Ⅰ型自剪接内含子(groupⅠ self-splicing introns)和Ⅱ型自剪接内含子(groupⅡ self-splicing introns)。通过内含子和外显子序列重新排列(Permuted Intron Exon, PIE),基于 I 型或 II 型内含子的自剪接功能剪接成环。
I 型内含子自剪接:
通过改造鱼腥藻(Anabaena)或 T4 噬菌体 I 型内含子提高了体外编码 RNA 的环化效率,在 Mg2+ 和 GTP 存在下,发生两次酯交换反应,形成 circRNA。为了进一步提高自剪接前体 RNA 成环效率,通过增加同源臂 (homology arm)、间隔序列 (spacer),解决长编码 RNA 序列成环的难题,并且能够得到较好的成环效率。并且筛选出的 IRES 增强了 circRNA 在细胞内蛋白表达的稳定性和效率。这种成环策略由于增加了间隔序列且外显子序列较长,所以需要在最终的 circRNA 产物中分别额外引入 176nt(Anabaena)和 74nt(T4 bacteriophage)碱基序列。
II 型内含子自剪接:
II 型内含子来源于原生生物、真菌以及细菌基因组中。与 I 型内含子 PIE 系统相比,使用 II 型内含子不需辅助外显子序列,即可产生预期的 circRNA 序列,但是该方法剪接效率低,成环条带中含有的 nicked RNA 需要进一步鉴定,广泛适用性仍需更多研究验证。

基于 PIE 系统自剪接机制
不同环化方法的比较

安升达 circRNA 合成服务
制备流程

服务优势
- 纯度高
安升达优化升级了生产制备流程,可得到高纯度的 circRNA,Agilent 2100 检测无明显的 nick RNA 残留峰
- 免疫原性低
免疫原性更低,可直接用于细胞转染和动物实验
- 多重 QC
多重质控标准,确保品质,满足客户不同研究阶段的需求
- 稳定表达
半衰期长,转染细胞后,连续检测 10 天内均可观察到蛋白表达
- 快速交付
制备周期短,最快 2 周即可交付
案例分享展示
1.RNase R 耐受实验
circRNA 和等量不相关的线性 RNA 在相同条件下进行 RNase R 消化,结果 circRNA 可以耐受 RNase R 的消化,不相关的线性 RNA 不能耐受 RNase R 消化,符合 circRNA 的性质。

2. 反转录后 PCR 扩增及测序:
1)PCR 扩增产物电泳检测:将 circRNA 用特异性引物逆转录得到 cDNA,对目标区域进行 PCR 后,电泳检测并将纯化后的 PCR 产物进行 Sanger 测序。

2)接口测序验证:正向、反向测序结果均显示产物 circRNA 在特定的位点发生了环化。

接口处 Sanger 测序验证
3)RNA 全长测序:步骤 1)分段测序拼接后,与预期 circRNA 序列完全相符。
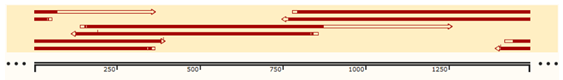
circRNA 测序结果拼接示意图
4)毛细管电泳检测:纯化后 circRNA 经 2100 检测,circRNA 的纯度高,无 nicked RNA 残留峰。

3.GFP circRNA 胞内测试
分别转染 GFP-circRNA 和 GFP linear mRNA 到 HEK293T 细胞中,均可高效表达 GFP 蛋白,转染后的第 10 天依然能观察到荧光,和线性的 RNA 相比,circRNA 更稳定,半衰期更长。

4.Gaussia Luciferase circRNA 胞内测试
Gaussia Luciferase (GLuc) 是一种来源于海洋桡脚类动物 Gaussia princeps 的 Gaussia 分泌型荧光素酶,因其可分泌、易于监测、灵敏度高、半衰期短等特性,可进行活细胞或生物体实时监测。分别转染 2 种方案(优化前和优化后)的 Glu circRNA 到 HEK293T 中,转染 24h 后,每天取细胞上清,均可检测到 Glu 蛋白的高效表达,其中,优化后制备的 Glu circRNA 蛋白表达量是优化前的 5 倍左右。

注:S1:Scheme 1(优化前);S2:Scheme 2(优化后)
参考文献
【1】Patop, Ines Lucia et al. Past, present, and future of circRNAs. The EMBO Journal, 2019, 38(16): e100836
【2】Greene J, Baird AM, Brady L, Lim M, Gray SG, McDermott R, Finn SP. Circular RNAs: Biogenesis, Function and Role in Human Diseases. Front Mol Biosci. 2017 Jun 6;4:38. doi: 10.3389/fmolb.2017.00038. PMID: 28634583; PMCID: PMC5459888.
【3】Chen X, Yang T, Wang W, Xi W, Zhang T, Li Q, Yang A, Wang T. Circular RNAs in immune responses and immune diseases. Theranostics. 2019 Jan 1;9(2):588-607. doi: 10.7150/thno.29678. PMID: 30809295; PMCID: PMC6376182.
【4】Lu D, Chatterjee S, Xiao K, Riedel I, Huang CK, Costa A, Cushman S, Neufeldt D, Rode L, Schmidt A, Juchem M, Leonardy J, Büchler G, Blume J, Gern OL, Kalinke U, Wen Tan WL, Foo R, Vink A, van Laake LW, van der Meer P, Bär C, Thum T. A circular RNA derived from the insulin receptor locus protects against doxorubicin-induced cardiotoxicity. Eur Heart J. 2022 Nov 7;43(42):4496-4511. doi: 10.1093/eurheartj/ehac337. PMID: 35758064; PMCID: PMC9637424.
【5】Wesselhoeft RA, Kowalski PS, Anderson DG. Engineering circular RNA for potent and stable translation in eukaryotic cells. Nat Commun. 2018 Jul 6;9(1):2629. doi: 10.1038/s41467-018-05096-6. PMID: 29980667; PMCID: PMC6035260.
【6】Qu L, Yi Z, Shen Y, Lin L, Chen F, Xu Y, Wu Z, Tang H, Zhang X, Tian F, Wang C, Xiao X, Dong X, Guo L, Lu S, Yang C, Tang C, Yang Y, Yu W, Wang J, Zhou Y, Huang Q, Yisimayi A, Liu S, Huang W, Cao Y, Wang Y, Zhou Z, Peng X, Wang J, Xie XS, Wei W. Circular RNA vaccines against SARS-CoV-2 and emerging variants. Cell. 2022 May 12;185(10):1728-1744.e16. doi: 10.1016/j.cell.2022.03.044. Epub 2022 Apr 1. PMID: 35460644; PMCID: PMC8971115.
【7】Obi P, Chen YG. The design and synthesis of circular RNAs. Methods. 2021 Dec;196:85-103. doi: 10.1016/j.ymeth.2021.02.020. Epub 2021 Mar 2. PMID: 33662562; PMCID: PMC8670866.
【8】Chen H, Cheng K, Liu X, An R, Komiyama M, Liang X. Preferential production of RNA rings by T4 RNA ligase 2 without any splint through rational design of precursor strand. Nucleic Acids Res. 2020 May 21;48(9):e54. doi: 10.1093/nar/gkaa181. PMID: 32232357; PMCID: PMC7229815.
【9】Chen H, Cheng K, Liu X, An R, Komiyama M, Liang X. Preferential production of RNA rings by T4 RNA ligase 2 without any splint through rational design of precursor strand. Nucleic Acids Res. 2020 May 21;48(9):e54. doi: 10.1093/nar/gkaa181. PMID: 32232357; PMCID: PMC7229815.
以上为本次分享的全部内容,如需了解更多信息,欢迎随时联系我们,我们将竭诚为您服务!
关于安升达基因编辑
安升达在全面的一二三代测序服务 (读基因),和经验丰富的基因合成服务 (写基因) 基础上,隆重推出了 CRISPR 基因编辑服务 (编基因),包括:高通量基因编辑一站式服务 (CRISPR Screen),细胞基因编辑服务,长单链 DNA(ssDNA) 合成服务,病毒包装服务等产品。安升达具有全基因组 sgRNA 设计平台;全基因组 sgRNA 合成平台;慢病毒包装及稳转细胞系构建平台;高通量测序 + 筛选分析平台;为您解决 CRISPR-SCREEN 任一环节难题,提供高质量一站式解决方案。
案例分享展示
1.RNase R 耐受实验
circRNA 和等量不相关的线性 RNA 在相同条件下进行 RNase R 消化,结果 circRNA 可以耐受 RNase R 的消化,不相关的线性 RNA 不能耐受 RNase R 消化,符合 circRNA 的性质。

2. 反转录后 PCR 扩增及测序:
1)PCR 扩增产物电泳检测:将 circRNA 用特异性引物逆转录得到 cDNA,对目标区域进行 PCR 后,电泳检测并将纯化后的 PCR 产物进行 Sanger 测序。

2)接口测序验证:正向、反向测序结果均显示产物 circRNA 在特定的位点发生了环化。

接口处 Sanger 测序验证
3)RNA 全长测序:步骤 1)分段测序拼接后,与预期 circRNA 序列完全相符。

circRNA 测序结果拼接示意图
4)毛细管电泳检测:纯化后 circRNA 经 2100 检测,circRNA 的纯度高,无 nicked RNA 残留峰。

3.GFP circRNA 胞内测试
分别转染 GFP-circRNA 和 GFP linear mRNA 到 HEK293T 细胞中,均可高效表达 GFP 蛋白,转染后的第 10 天依然能观察到荧光,和线性的 RNA 相比,circRNA 更稳定,半衰期更长。

4.Gaussia Luciferase circRNA 胞内测试
Gaussia Luciferase (GLuc) 是一种来源于海洋桡脚类动物 Gaussia princeps 的 Gaussia 分泌型荧光素酶,因其可分泌、易于监测、灵敏度高、半衰期短等特性,可进行活细胞或生物体实时监测。分别转染 2 种方案(优化前和优化后)的 Glu circRNA 到 HEK293T 中,转染 24h 后,每天取细胞上清,均可检测到 Glu 蛋白的高效表达,其中,优化后制备的 Glu circRNA 蛋白表达量是优化前的 5 倍左右。

注:S1:Scheme 1(优化前);S2:Scheme 2(优化后)
参考文献
【1】Patop, Ines Lucia et al. Past, present, and future of circRNAs. The EMBO Journal, 2019, 38(16): e100836
【2】Greene J, Baird AM, Brady L, Lim M, Gray SG, McDermott R, Finn SP. Circular RNAs: Biogenesis, Function and Role in Human Diseases. Front Mol Biosci. 2017 Jun 6;4:38. doi: 10.3389/fmolb.2017.00038. PMID: 28634583; PMCID: PMC5459888.
【3】Chen X, Yang T, Wang W, Xi W, Zhang T, Li Q, Yang A, Wang T. Circular RNAs in immune responses and immune diseases. Theranostics. 2019 Jan 1;9(2):588-607. doi: 10.7150/thno.29678. PMID: 30809295; PMCID: PMC6376182.
【4】Lu D, Chatterjee S, Xiao K, Riedel I, Huang CK, Costa A, Cushman S, Neufeldt D, Rode L, Schmidt A, Juchem M, Leonardy J, Büchler G, Blume J, Gern OL, Kalinke U, Wen Tan WL, Foo R, Vink A, van Laake LW, van der Meer P, Bär C, Thum T. A circular RNA derived from the insulin receptor locus protects against doxorubicin-induced cardiotoxicity. Eur Heart J. 2022 Nov 7;43(42):4496-4511. doi: 10.1093/eurheartj/ehac337. PMID: 35758064; PMCID: PMC9637424.
【5】Wesselhoeft RA, Kowalski PS, Anderson DG. Engineering circular RNA for potent and stable translation in eukaryotic cells. Nat Commun. 2018 Jul 6;9(1):2629. doi: 10.1038/s41467-018-05096-6. PMID: 29980667; PMCID: PMC6035260.
【6】Qu L, Yi Z, Shen Y, Lin L, Chen F, Xu Y, Wu Z, Tang H, Zhang X, Tian F, Wang C, Xiao X, Dong X, Guo L, Lu S, Yang C, Tang C, Yang Y, Yu W, Wang J, Zhou Y, Huang Q, Yisimayi A, Liu S, Huang W, Cao Y, Wang Y, Zhou Z, Peng X, Wang J, Xie XS, Wei W. Circular RNA vaccines against SARS-CoV-2 and emerging variants. Cell. 2022 May 12;185(10):1728-1744.e16. doi: 10.1016/j.cell.2022.03.044. Epub 2022 Apr 1. PMID: 35460644; PMCID: PMC8971115.
【7】Obi P, Chen YG. The design and synthesis of circular RNAs. Methods. 2021 Dec;196:85-103. doi: 10.1016/j.ymeth.2021.02.020. Epub 2021 Mar 2. PMID: 33662562; PMCID: PMC8670866.
【8】Chen H, Cheng K, Liu X, An R, Komiyama M, Liang X. Preferential production of RNA rings by T4 RNA ligase 2 without any splint through rational design of precursor strand. Nucleic Acids Res. 2020 May 21;48(9):e54. doi: 10.1093/nar/gkaa181. PMID: 32232357; PMCID: PMC7229815.
【9】Chen H, Cheng K, Liu X, An R, Komiyama M, Liang X. Preferential production of RNA rings by T4 RNA ligase 2 without any splint through rational design of precursor strand. Nucleic Acids Res. 2020 May 21;48(9):e54. doi: 10.1093/nar/gkaa181. PMID: 32232357; PMCID: PMC7229815.
以上为本次分享的全部内容,如需了解更多信息,欢迎随时联系我们,我们将竭诚为您服务!
关于安升达基因编辑
安升达在全面的一二三代测序服务 (读基因),和经验丰富的基因合成服务 (写基因) 基础上,隆重推出了 CRISPR 基因编辑服务 (编基因),包括:高通量基因编辑一站式服务 (CRISPR Screen),细胞基因编辑服务,长单链 DNA(ssDNA) 合成服务,病毒包装服务等产品。安升达具有全基因组 sgRNA 设计平台;全基因组 sgRNA 合成平台;慢病毒包装及稳转细胞系构建平台;高通量测序 + 筛选分析平台;为您解决 CRISPR-SCREEN 任一环节难题,提供高质量一站式解决方案。